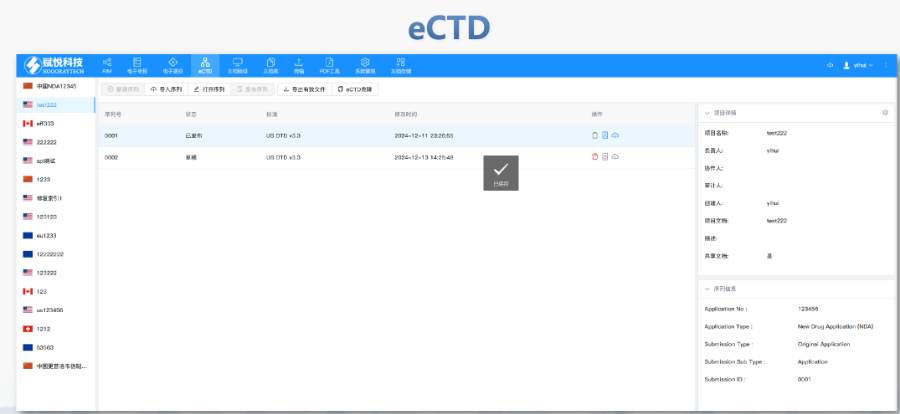
ANDA递交: 按照ICH M4的CTD格式整理资料,并以eCTD格式递交; 通过ESG通道递交资料; 收到CDER的letter,说明资料已经进入FDA数据库; 付GDUFA费,在资料递交后的10日内到账; ANDA接收: 缴费后,FDA初步审查资料的完整性,并会在60天给答复。 第一种情况是ANDA无缺陷,FDA给申请人发受理信(Acceptance Letter); 第二种情况是ANDA包含少于10个小缺陷,FDA将会通过电话、传真、电子邮件等方式通知发布IR (信息请求函),让申请人在7个日历日内改正,若未按时补充所有需要的资料,FDA将拒收该ANDA; 第三种情况是ANDA包含1个或者多个重大缺陷,或10个以上的小缺陷,FDA将拒收该ANDA; 注:如果这边被拒收,只退75%的费用。欧盟IND注册申报相关技术支持。高新区国内注册eCTD医疗科技
美国eCTD验证采用三级分类:“错误”(必须修正)、“警告”(建议修正)、“提示信息”(参考)。例如,PDF文件版本不符或加密保护属于“错误”,而书签路径非相对性则可能列为“警告”。验证失败将直接导致退审,企业需通过LORENZ Validator等工具预检,确保提交前合规。 技术验证点 验证涵盖XML结构合规性、文件命名规则、生命周期管理(如序列号连续性)及PDF属性(如字体嵌入、可搜索性)。临床试验数据需额外满足CDISC标准,包括SDTM和ADaM数据集的结构验证杨浦区化学药品eCTD服务电话瑞士NDA注册申报相关技术支持。
仿制药作为提高药物可及性与可负担性的一类药物,2012年以前,注册审评是不收取任何费用的,但当时仿制药申请积压严重,从申报到获批需要3~5年的时间。 美国国会于2012年颁布了仿制药使用者费用修正案(Generic Drug User Fee Amendments, GDUFA),该法律要求制药行业支付一定的用户费用,以补充仿制药申请的审评以及现场检查的费用,减少仿制药申请积压,缩短审评时间,增加基于风险的现场检查等,其目的是加快公众获得安全有效的仿制药,并降低行业成本。 GDUFA必须每五年重授权一次,于2017年更(GDUFA II),于2022年更(GDUFA III); 目前收费种类分为以下四种:ANDA审评费、DMF审评费,在审评时一次性缴纳;项目费(Program fee)、设施费(Facility fee),是上市后每年缴纳一次。
危机应对与应急递交机制 在公共卫生紧急事件(如COVID-19)中,EMA允许简化eCTD序列,优先审评关键模块并暂缓非数据。申请人可通过快速通道(Fast Track)提交疫苗或药物的eCTD资料,审评周期可压缩至6个月。此类申请需附风险评估报告,并承诺后续补交完整数据。 数据安全与长期存档 欧盟要求eCTD资料存档期限至少为药品上市后30年,EMA采用分布式存储和区块链技术确保数据不可篡改。申请人需定期备份本地副本,并使用符合GDPR要求的加密传输协议(如AS2)递交。历史数据的迁移和格式转换(如NeeS转eCTD)需遵循特定技术规范。 环保效益与可持续发展 eCTD取代纸质递交后,欧盟每年减少约500吨纸张消耗,审评流程的数字化降低碳足迹约30%。虚拟审评会议和电子签名进一步减少了差旅需求,契合欧盟2050碳中和目标。未来,eCTD4.0将通过数据压缩技术进一步降低服务器能耗。加拿大DMF注册申报关技术支持。

GDUFA III框架与费用分类 2022年更的GDUFA III将费用分为ANDA申请费、DMF认证费、项目费及设施费四类,实施周期至2027年。2025财年ANDA费用涨至约22万美元,较2024年增幅达27.5%,反映审评成本上升。 ANDA申请费规则 费用需在提交时缴纳,若申请被拒可退还75%。重提交视为申请,需再次缴费。关联API的工厂数量影响总费用,例如某ANDA引用3个API且涉及6家工厂,需支付6倍DMF费用。 DMF费用机制 II类原料药DMF需在引用前缴费,一次性支付约5.3万美元(2025财年)。未缴费DMF不得用于支持ANDA,否则触发退审。 项目费分级管理 根据企业获批ANDA数量分为大、中、小型三级,2025年大型企业年费约34万美元。附属公司ANDA数量合并计算,缴费责任可由母公司或任一附属公司承担。加拿大eCTD申报相关技术支持。杨浦区化学药品eCTD服务电话
欧盟DMF注册申报相关技术支持。高新区国内注册eCTD医疗科技
电子签章与安全性 FDA要求所有PDF文件需经数字签名,并通过MD5校验确保传输完整性。签章需符合21 CFR Part 11的电子记录规范,部分情况下允许临时放宽(如期间的远程签署)。 多模块协同验证 模块1(行政文件)的区域性元数据(如申请类型、联系人信息)需与模块2-5的内容逻辑一致。例如,生物制品的3.2.R扩展节点命名需遵循特定规则,而化学药品则禁止使用此类扩展。 验证工具与流程 主流工具如LORENZ eValidator支持自动化验证,生成包含错误定位与修复建议的详细报告。企业需在提交前完成内部验证,并通过“药品业务应用系统”推送受理状态。 常见问题与规避策略 高频错误包括PDF安全设置、书签链接失效、STF(研究标签文件)缺失等。例如,未在5.3.1章节标注研究ID会导致验证警告,需通过说明函解释。企业可通过建立标准化模板库和预检流程降低风险。 后续监管与更 FDA定期更验证标准(如2022年增临床试验数据完整性检查),企业需通过订阅官方通知或第三方服务商获取动态高新区国内注册eCTD医疗科技