ANDA一般不需要提供临床前(动物)和临床(人体)数据来证明其安全性和有效性(即免毒理和临床),作为替代,申请人必须合理证明其产品与原研药相比是生物等效的。 按照《联邦食品、药品和化妆品法》第 505(j)章要求,拟向FDA递交申请ANDA的药品需符合以下条件: 仿制药必须依照FDA《经过医疗等同性评价批准的药品》(俗称"橙皮书")上所列,由FDA选定的RLD/RS进行对照仿制; 活性成份、剂型、规格、给药途径、适应症,要与RLD相同; 仿制药必须证明与RLD在生物效果上等同,即具有生物等效性; 必须按照美国联邦管理法21 CFR遵行药品生产管理规范控制生产过程; 无论中国还是美国,要求仿制药的质量必须等同或者是高于参比制剂的,这是获批的基本要点; 注意:如果原研药未被列为RLD,申请人可以提出公民,向FDA申请。eCTD申报相关技术支持。安徽新药eCTD业务
欧洲药品管理局:集中审评程序由欧洲药品管理局(European Medicines Agency, EMA)负责协调。 人用药品委员会:人用药品委员会(Committee for Medicinal Products for Human Use, CHMP)负责提供科学意见。 欧盟委员会:CHMP的意见随后被提交给欧盟委员会(European Commission, EC),由欧盟委员会做出是否授权的终决定。这个决定在整个欧盟都是具有法律约束力的。 审批过程: 申请人向EMA提交申请,包括eCTD(电子通用技术文档)格式的药品注册文档。 EMA的CHMP分配一个科学评估团队(Rapporteur和Co-Rapporteur),负责初步评估。 CHMP基于评估团队的报告提供科学意见。 欧盟委员会根据CHMP的意见做出终决定,批准或拒绝药品上市。 授权范围 如果药品获得批准,将获得在整个欧盟、冰岛、列支敦士登和挪威有效的上市许可(Central Marketing Authorisation, CMA)。闵行区药品注册eCTD欢迎选购澳大利亚的eCTD申报相关技术支持。

申报流程与要求 资料准备 内容要求:包括产品描述、生产工艺(原材料来源、设备参数等)、质量控制标准(SOP、稳定性数据)、安全性与毒性研究等。 格式规范: 采用CTD(通用技术文件)格式,按模块分章节(如模块3为CMC数据)。 电子提交需符合eCTD标准(文件小于10GB通过ESG系统提交,超过可选用CD-ROM)。 提交与注册 预分配DMF号:需在提交前申请,确保文件与编号绑定。 授权书(LOA):需向引用DMF的制剂厂商提供授权信,明确可查阅的章节。 费用:Ⅱ类原料药DMF需缴纳年费(2024年约9,468美元)。 FDA审核流程 行政审评:2-3周内确认文件完整性。 完整性审评(CA):针对Ⅱ类DMF,约60天。 技术审评:在DMF被制剂申请(如ANDA、NDA)引用时启动,周期60-180天。 结果反馈:FDA可能要求补充数据,但DMF本身无“批准”状态,通过后可能收到“无进一步意见函”(No Further Comment Letter)。
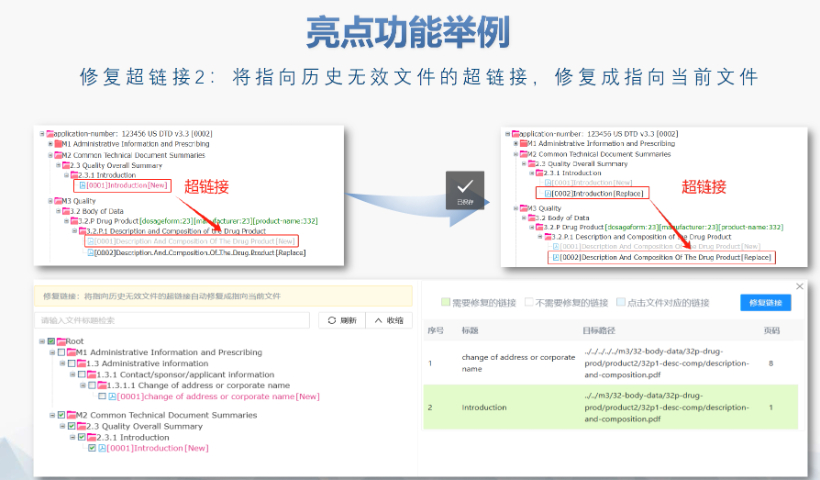
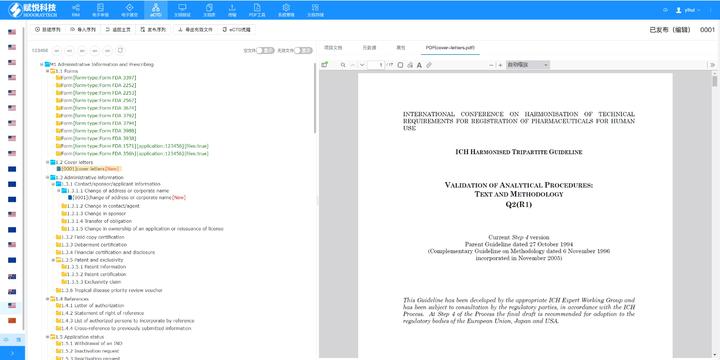
eCTD提交流程与ESG系统:FDA要求通过电子提交网关(ESG)传输eCTD文件,单个文件大小限制为10GB,超限需拆分或通过物理介质(如光盘)递交。提交前需预分配申请号(如NDA编号),并通过ESG测试账户验证技术合规性。序列号命名规则为4位数字(如0001),申请需从“原申请”序列开始,补充资料按递增顺序编号。企业可自愿提交预审样本(Pre-Submission),FDA将反馈文档结构、元数据等合规性问题。验证标准与常见错误类型:FDA验证标准分为高(High)、中(Medium)、低(Low)三级,高风险错误(如无效XML或缺失关键表格)必须修复,否则直接拒收。常见问题包括:重复序列号(错误1034)、文件路径超长(警告2015)、PDF加密或非标字体(错误4001)。2023年统计显示,30%的提交因模块1格式错误被退回,凸显行政信息合规的重要性。验证工具如LORENZ eValidator被FDA官方采用,可自动检测200+项技术指标。加拿大DMF注册申报关技术支持。
美国eCTD验证采用三级分类:“错误”(必须修正)、“警告”(建议修正)、“提示信息”(参考)。例如,PDF文件版本不符或加密保护属于“错误”,而书签路径非相对性则可能列为“警告”。验证失败将直接导致退审,企业需通过LORENZ Validator等工具预检,确保提交前合规。 技术验证点 验证涵盖XML结构合规性、文件命名规则、生命周期管理(如序列号连续性)及PDF属性(如字体嵌入、可搜索性)。临床试验数据需额外满足CDISC标准,包括SDTM和ADaM数据集的结构验证瑞士ANDA注册申报相关技术支持。合肥CDE eCTD欢迎选购
澳大利亚IND注册申报相关技术支持。安徽新药eCTD业务
从纸质到电子的历史过渡 2017年前,美国允许纸质与eCTD并行提交,但此后逐步淘汰纸质通道,保留紧急情况下的例外审批。2020年电子化后,所有IND、NDA、ANDA和DMF强制采用eCTD格式。 系统平台升级 FDA通过“药品业务应用系统”和“药品eCTD注册系统”实现电子资料接收、受理与审评的全流程数字化。2022年系统增自动推送受理文书和短信提醒功能,减少人工干预。 电子文档结构优化 美国eCTD采用分层文件夹结构,例如化学药品的模块1-5分别对应行政文件、总结报告、质量数据等。2020年后增“临床试验数据库”装盒要求,强化数据可追溯性。安徽新药eCTD业务
赋悦科技(杭州)有限责任公司是一家有着雄厚实力背景、信誉可靠、励精图治、展望未来、有梦想有目标,有组织有体系的公司,坚持于带领员工在未来的道路上大放光明,携手共画蓝图,在浙江省等地区的数码、电脑行业中积累了大批忠诚的客户粉丝源,也收获了良好的用户口碑,为公司的发展奠定的良好的行业基础,也希望未来公司能成为*****,努力为行业领域的发展奉献出自己的一份力量,我们相信精益求精的工作态度和不断的完善创新理念以及自强不息,斗志昂扬的的企业精神将**赋悦科技供应和您一起携手步入辉煌,共创佳绩,一直以来,公司贯彻执行科学管理、创新发展、诚实守信的方针,员工精诚努力,协同奋取,以品质、服务来赢得市场,我们一直在路上!